Bon, pour un vaccin maintenant :
-
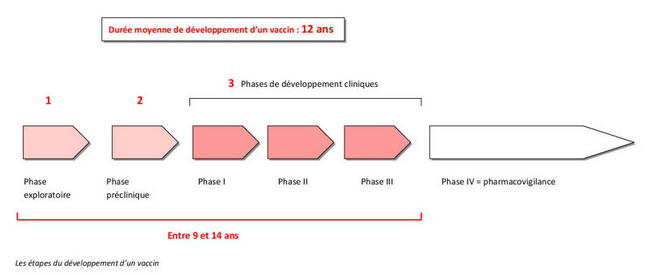
- Capture d’écran du 2021-03-17 00-25-02.png (53.26 Kio) Vu 1065 fois
"
Les essai précliniques.
Les vaccins sont d’abord étudiés en laboratoire et testés chez l’animal. Cette étape indispensable ne préjuge pas des résultats chez l’homme.
Les essais cliniques.
Les essais cliniques, chez l’homme, comprennent
trois phases successives qui correspondent à des objectifs différents.
La phase I (innocuité) dure de un à deux ans. Elle a pour objectif de déterminer :
L’innocuité du candidat-vaccin chez l’homme : provoque-t-il des effets indésirables sérieux ?
Sa tolérance : comment le corps réagit-il au produit ?
Son immunogénicité : le candidat-vaccin génère-t-il une réponse immunitaire ?
La phase IIA (immunogénicité et dosage) dure de un à deux ans. Les essais sont réalisés sur un très petit nombre de volontaires.
On continue à vérifier la tolérance et l’innocuité du candidat-vaccin.
On continue à surveiller son immunogénicité.
On cherche à établir la dose optimale de vaccin à utiliser.
La phase IIB, encore appelée « preuve de concept » ou « validation de principe », dure de deux à cinq ans. Les essais sont réalisés sur un nombre plus élevé de volontaires et ont pour objectif de déterminer si :
Le vaccin procure bien une protection durable contre l’infection
La stratégie vaccinale (A quel moment, quelle dose, quelle fréquence adopter ?) est susceptible de fonctionner pour réduire le risque de transmission du pathogène
Un essai de phase III est envisageable
La phase III (efficacité et bénéfices/risques) dure de trois à cinq ans. Des essais testent sur des centaines, voire des milliers, de personnes le rapport bénéfices/risques du vaccin. Ces études pivots permettent de définir les conditions et les précautions d’emploi du vaccin et, à terme, de poser des demandes d’AMM auprès des agences du médicament.
Deux étapes de recherche peuvent être associées (essai de phase I/II par exemple), ce qui permet d’accélérer un peu le processus.
Les Agences du médicament examinent l’ensemble des éléments disponibles, autorisent ou non la commercialisation, définissent le cadre et les conditions d’utilisation du vaccin.
Le CTV élabore la stratégie vaccinale (quelles populations vacciner) en fonction des données épidémiologiques, des études bénéfice-risque individuel et collectif et d'études médico-économiques. Il propose aussi des adaptations pour la mise à jour du calendrier vaccinal.
Quand un vaccin est commercialisé, il entre en
phase de pharmacovigilance, parfois appelée phase IV. Patients et médecins sont incités à déclarer des effets secondaires non signalés aux instances de surveillance (en France, l’ANSM). Cette phase dure tant que le vaccin reste commercialisé."
Ça ne nous dit pas comment ils font pour connaître l'efficacité de manière éthique. Je cherche...
